大阪大学 消化器内科学 自主臨床研究
| 研究課題 | C型慢性肝疾患患者に対するTVR/Peg-IFN/RBV併用療法におけるTVR減量投与の非劣性の検討:多施設共同無作為化比較試験 |
|---|
| 実施期間 | 2016年12月31日まで |
|---|---|
| 研究機関 | 大阪大学医学部附属病院 消化器内科 および以下の関連施設 国立病院機構大阪医療センター 消化器科 、国立病院機構大阪南医療センター 消化器内科 国立病院機構南和歌山医療センター 消化器内科、大阪労災病院 消化器内科 関西労災病院 消化器内科、大阪警察病院 消化器内科 大阪府立成人病センター 肝胆膵内科、大阪府立急性期・総合医療センター 消化器内科 公立学校共済組合近畿中央病院 消化器内科 、国家公務員共済組合連合会大手前病院 消化器内科 大阪厚生年金病院 内科 、県立西宮病院 内科 箕面市立病院 消化器内科、市立池田病院 消化器内科 市立伊丹病院 消化器内科、市立豊中病院 消化器内科 市立吹田市民病院 内科、市立芦屋病院 内科 西宮市立中央病院 内科、八尾市立病院 消化器内科 東大阪市立総合病院 消化器内科、住友病院 消化器内科 NTT西日本大阪病院 消化器内科、大阪府済生会千里病院 消化器内科 明和病院 内科、大阪回生病院 内科 笹生病院 内科 |
| 主任研究者 | 竹原 徹郎 |
| 研究目的 |
C型慢性肝炎は肝硬変に進行すると肝癌の発生率が約8%と高くなります。肝癌を予防するためには、C型肝炎ウイルス(HCV)を排除し、肝硬変へ進行しないようにする必要があります。C型慢性肝炎患者さんに対しては、ペグインターフェロン・リバビリン併用療法が行われていますが、難治性のHCV遺伝子型(ジェノタイプ)1型・高ウイルス量症例におけるHCV排除率は約50%であり、約半数の症例ではHCV感染が持続します。 さらに治療効果を良くするために、HCVのウイルス複製を阻害するプロテアーゼ阻害剤であるテラプレビルが開発されました。海外、国内での臨床試験の結果、HCV ジェノタイプ1 型のC型慢性肝炎患者さんに対するテラプレビル・ペグインターフェロン・リバビリン併用療法(24週間投与)では、ペグインターフェロン・リバビリン併用療法(48週間投与)と比べて、治療期間が短縮されてもHCV排除率が約70%にまで向上することが明らかとなりました。また、ペグインターフェロン・リバビリン併用療法でウイルスが排除出来なかった患者さん(再燃、無効)への効果も認められ、2012年1月より、テラプレビル・ペグインターフェロン・リバビリン併用療法による治療が出来るようになりました。 しかし、テラプレビルをペグインターフェロン・リバビリンに併用することで、副作用がさらに強く出現し、特に重篤な貧血ならびに皮疹を認めることから、治療を中断する症例も少なくありません。国内の臨床試験では、重篤な貧血(12%)、皮疹(7%)が報告されています。特に重篤な皮疹として、Stevens-Johnson症候群(粘膜皮膚眼症候群であり、急激に発症する重篤な皮膚・粘膜の炎症性疾患。)、多型紅斑が0.8%ずつに認められています。一方で、テラプレビルを一日に内服する量を3錠(2250mg/日)から2錠(1500mg/日)に減量してもその効果は変わらないといった報告もあり、テラプレビルの最適な投与量についてはこれからの検討が必要な状況です。貧血の原因としてテラプレビル以外にリバビリンも挙げられますが、国内の臨床試験ではテラプレビルの減量は行わずにリバビリンのみを減量しています。また、我々の研究から、リバビリンを減量することによって治療効果が減弱することも明らかとなっています。これらのことより、私たちは、テラプレビルをあらかじめ減量しておくことで、重篤な副作用を避けつつ(貧血が進行せず)、結果としてリバビリンを減量せずに済むことで、治療効果が良くなる可能性があると考えています。しかし、テラプレビルの減量開始により治療効果が減弱する可能性も否定はできません。このように、テラプレビル・ペグインターフェロン・リバビリン3剤併用療法において、テラプレビルの至適用量を検討することが必要です。 本試験の目的は、テラプレビル・ペグインターフェロン・リバビリン併用療法を施行するC型慢性肝炎の患者さんを対象として、テラプレビル2錠(1500mg/日)投与での治療効果が、テラプレビル3錠(2250mg/日)投与の場合に比べて、副作用が少なく、また、治療効果が劣らないかどうかを調べることにあります。この試験によって、テラプレビルの至適用量を決定することにより、これからこの治療を受けられる患者さんの副作用の軽減や、治療効果の向上へとつながる可能性があります。 |
| 対象 |
目標症例数:280例 以下の基準を満たしている患者さんがこの試験に参加することが可能です。 <主な参加基準> 1)年齢は20歳以上 2)過去に抗ウイルス治療歴のないHCV遺伝子型(ジェノタイプまたはセロタイプ)1型、かつ高ウイルス量(アンプリコアハイレンジ法で100KIU/ml以上、またはリアルタイムPCR法で5.0 log IU/ml以上)のC型慢性肝炎患者さん <主な除外基準> 1)HBs抗原陽性B型肝炎ウイルスに感染している患者さん 2)HIV抗体陽性ヒト免疫不全ウイルスに感染している患者さん 3)他の慢性肝疾患のある患者さん(自己免疫性肝炎、アルコール性肝炎など) 4)非代償性肝硬変ならびに肝不全の患者さん 5)慢性腎不全あるいはクレアチニンクリアランスが50ml/min以下の腎機能障害のある患者さん 6)重篤な多臓器疾患合併症例、ならびに免疫不全状態にある患者さん 7)ヘモグロビン値12g/dL未満、血小板値100000/mm3未満 8)重度のうつ病、その他重篤な精神疾患症例またはその既往歴のある患者さん 9)妊娠中、授乳中、妊娠を予定している患者さん 10)医師、責任医師が不適と認めた患者さん |
| 研究方法 |
試験にご参加いただく患者さんには、参加後に性別や年齢、血小板数などに応じて2つのグループ(グループA、グループB)のどちらかに分かれていただき、それぞれの治療を行います。あなたがどちらのグループになるかは試験への参加が決まるまでは担当医師を含めて誰にも分からないようになっています。このような方法を「無作為化」といいます。
 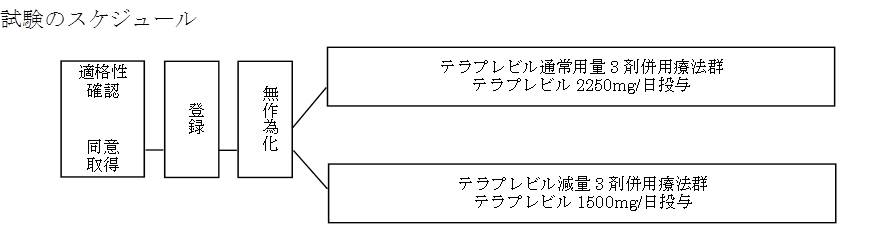 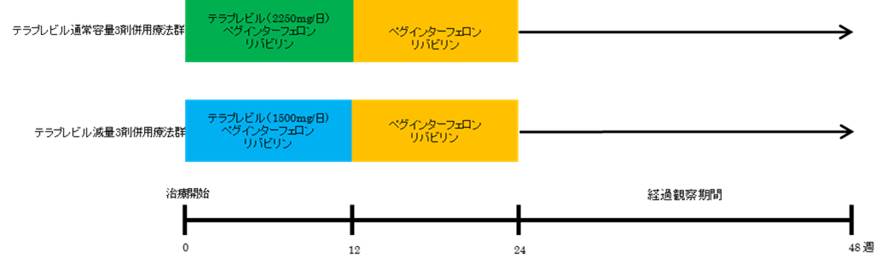 ※テラプレビル通常用量3剤併用療法、テラプレビル減量3剤併用療法のいずれにおいても、治療開始4週でウイルス量が3log IU/ml以下に低下しない場合、あるいは治療開始12週でウイルスが陰性化しない場合は治療を終了する。 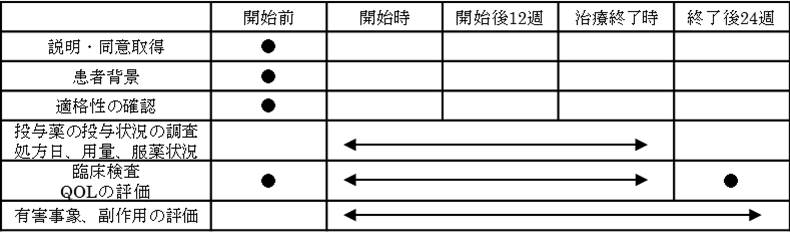 ※テラプレビルの添付文書に従い、ヘモグロビン濃度、白血球数、好中球数及び血小板数の検査は投与前および投与開始12週間は少なくとも毎週、その後は4週に1度実施する。 |
| プライバシーの 保護 |
1)参加された方の秘密は守られ、名前や個人を識別する情報は一切公開されません。 2)この試験で得られた情報を、関連学会や医学雑誌などに発表させていただくことがありますが、この場合であってもあなたの名前や個人を識別する情報は一切公開されません。 3)この試験に関わる関係者、この試験を審査する当院の委員会の担当者があなたのカルテ等を閲覧する場合がありますが、この場合であってもプライバシーは保護されます。 4)途中で試験を中止された場合は、中止までに実施した結果や、中止後のあなたの状況についても報告させて頂きますので、あらかじめご了承ください。なお、この場合であっても、あなたのプライバシーは守られますのでご安心ください。 |
| 本研究に関する 問い合わせ先 |
大阪大学消化器内科学 藥師神 崇行(講師) 連絡先電話番号:大阪大学消化器内科学(06-6879-3621) |


